La joven investigadora Sílvia Osuna (Castelló d’Empúries, 1983), química de la Universidad de Girona, ha abierto una nueva vía para abaratar los costes de fabricación de los fármacos mediante la química computacional. El avance le ha valido el Premio Fundación Princesa de Girona de este año en la categoría de investigación científica. Ahora, con la ayuda de una beca europea Starting Grant, comienza a diseñar enzimas para sintetizar nuevos medicamentos.
¿Qué es exactamente la química computacional?
Una técnica que aplica métodos matemáticos y ordenadores para resolver problemas químicos. Mediante diferentes programas o softwares se pueden calcular las estructuras, propiedades y reactividad de moléculas. En mi caso, uso programas de dinámica molecular, mecánica molecular y cuántica para proponer cambios en la estructura de las enzimas y acelerar así la reacción de interés. Con la química computacional se puden diseñar enzimas a la carta.
Es uno de los aspectos que destaca el jurado del Premio. ¿En qué consiste?
Las enzimas permiten hacer que las reacciones químicas tengan lugar de forma más rápida y eficiente. Son los catalizadores más eficientes que se conocen en la tierra. Con los ordenadores tratamos de predecir cómo modificar la estructura de las enzimas naturales para que hagan otras reacciones de interés farmacéutico para las cuales no fueron optimizadas. La idea es aplicar las enzimas para acelerar cualquier reacción que nos interese, y de aquí el nombre de ‘a la carta’.
¿Y cómo se aplica esto para abaratar la fabricación de medicamentos?
En comparación con los catalizadores tradicionales que se emplean en la producción de fármacos, las enzimas ofrecen muchas ventajas, ya que operan a temperatura ambiente, presión atmosférica, son biodegradables y proporcionan únicamente el producto deseado con un elevado rendimiento, ahorrando así pasos de purificación. Todos estos puntos tienen un impacto positivo en el coste de producción del medicamento. La idea es diseñar enzimas que aceleren las reacciones químicas de interés en la síntesis de fármacos, abaratando sus costes.
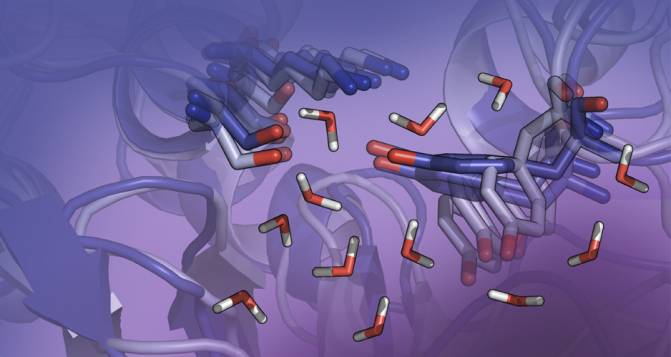
Representación de la flexibilidad de los residuos del centro activo de la enzima LovD. / Sílvia Osuna
¿Ese es el objetivo ahora de tus investigaciones en química computacional?
Sí. Se enmarcan dentro del proyecto NetMoDEzyme, que ha comenzado en mayo con financiación de una beca europea Starting Grant. Precisamente su objetivo es desarrollar un protocolo computacional que permita diseñar enzimas para reducir los costes de producción de los fármacos. Lo más novedoso e innovador del proyecto es la simplificación de los protocolos existentes para crear nuevas enzimas, teniendo en cuenta su carácter dinámico y las correlaciones de los diferentes elementos que componen su estructura.
¿Habéis publicado ya algún avance en revistas científicas?
Uno de los últimos artículos se presentó en Accounts of Chemical Research, donde demostramos la importancia de las simulaciones de dinámica molecular para ver el efecto que tienen las mutaciones (es decir, cambios en la estructura de estas moléculas) sobre la conformación y organización del centro activo de las enzimas.
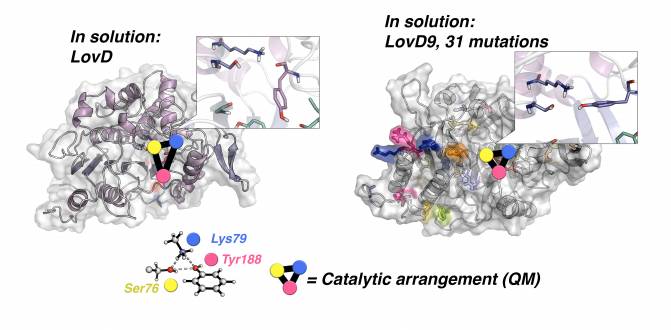
Representación de las conformaciones catalíticas y no catalíticas de los residuos del centro activo de la enzima natural LovD (izquierda) y la evolucionada con 31 cambios en la estructura (derecha). / Acc. Chem. Res./Sílvia Osuna
¿Alguna otra publicación?
En 2014 también presentamos en Nature Chemical Biology el diseño de nuevas enzimas para sintetizar Zocor, un fármaco usado para tratar pacientes con colesterol alto. Estas enzimas presentaban grandes diferencias de actividad catalítica, pero la inspección ‘estática’ de las estructuras de rayos X no podía establecer las bases de esas diferencias.

Portada de la revista Angew. Chem. Int. Ed. sobre la aromaticidad en cajas fullerénicas. Los fullerenos y otros compuestos de carbono son otra de las líneas de investigación de Sílvia Osuna, diseñadora de esta imagen.
Pero gracias al tratamiento ‘dinámico’ de las enzimas, mediante simulaciones de dinámica molecular, se pudo racionalizar la base molecular de la diferencia de actividad y el efecto de las mutaciones en los aminoácidos responsables de la catálisis.
La enzima LovD es la protagonista de estos trabajos. ¿Cuáles son sus propiedades?
Es una transesterasa, una enzima natural que convierte el ácido monacolin J (MJA, por sus siglas en inglés) en el medicamento lovastatina (de nombre comercial es Mevacor) mediante una reacción de acilación. En nuestros estudios se introdujeron cambios en la estructura de LovD para poder convertir MJA en un medicamento más potente, el simvastatin (Zocor), destinado a pacientes con problemas de colesterol.
En sus trabajos cuida especialmente el tema de las ilustraciones y los gráficos…
Para mí es muy importante saber representar mediante imágenes y gráficos los principales resultados obtenidos en cualquier proyecto científico. En mi caso, además, me gusta mucho pintar y disfruto con cualquier actividad creativa. Me encantan la ciencia y el arte, porque ambas disciplinas tienen en común la creatividad. Tanto en el arte como en la investigación, uno siempre tiene que ser creativo e intentar buscar la perfección en sus trabajos. Como decía Dalí: “No tengas miedo de la perfección, nunca la conseguirás”.