Investigadores de EE UU han hallado una correlación entre este trastorno psiquiátrico y un tipo de mutación genética no heredada que se produce en una fase temprana del desarrollo embrionario. El estudio abre la puerta a investigar si otros desórdenes podrían estar regulados por este tipo de mutaciones.
La OMS calcula que una de cada 300 personas en el mundo padece esquizofrenia, un trastorno psiquiátrico que aparece en la edad adulta por una combinación de factores genéticos y ambientales. Aunque aún se desconocen con exactitud las causas de esta enfermedad, que se manifiesta en una deficiente percepción de la realidad y que afecta al comportamiento de las personas a causa de las ideas o las alucinaciones que padecen.
Ahora, un grupo de investigadores del Harvard Medical School y otros centros de EE UU dan a conocer un estudio, que se publica en la revista Cell Genomics, en el que se observa una correlación entre la esquizofrenia y las variaciones somáticas del número de copias, un tipo de mutación que se produce en una fase temprana del desarrollo, pero después de que se herede el material genético.
En el artículo se describe ese vínculo entre las mutaciones genéticas somáticas —no heredadas— y el riesgo de esquizofrenia.
“Al principio pensábamos que la genética era el estudio de la herencia. Pero ahora sabemos que los mecanismos genéticos van mucho más allá”, sostiene el autor principal Chris Walsh, investigador del Instituto Médico Howard Hughes y jefe de genética y genómica del Hospital Infantil de Boston.
Lo que han analizado estos investigadores son precisamente las mutaciones que no se heredan de los padres.
Así, los expertos examinaron los datos de genotipos y marcadores de más de 20.000 muestras de sangre de personas con o sin esquizofrenia del Psyquiatric Genomics Consortium. Así identificaron dos genes —NRXN1 y ABCB11— que se correlacionaban con casos de esquizofrenia cuando se alteraban en el útero.
Aunque el NRXN1 (un gen que ayuda a transmitir señales por todo el cerebro) ya se había relacionado antes con esta dolencia psiquiátrica, aquí se observan las mutaciones somáticas, no hereditarias, que lo vinculan con la esquizofrenia.
Para saber si estas mutaciones son hereditarias, los científicos tuvieron que averiguar si estaban presentes en todas las células del organismo, puesto que las mutaciones somáticas solamente se observan en una fracción de las células. Y esa porción varía en función de cuándo y dónde se haya producido la mutación.
Si una mutación se produce en una fase temprana del desarrollo, se espera que la variante esté presente en todo el organismo en forma de mosaico.
Basándose en este principio, los investigadores pueden identificar mutaciones somáticas que ocurrieron en una fase temprana del desarrollo y se hallan no solo en el cerebro, sino también en una parte de las células de la sangre.
Así lo explica Chris Walsh a SINC: “El momento del suceso (la mutación) puede calcularse por la proporción de células que contienen la mutación. Si se produce cuando solo hay dos células en el embrión, cabe esperar que esté en la mitad de las células; si sucede cuando hay cuatro células, se encontrará en una cuarta parte de las células (aproximadamente) y así sucesivamente”.
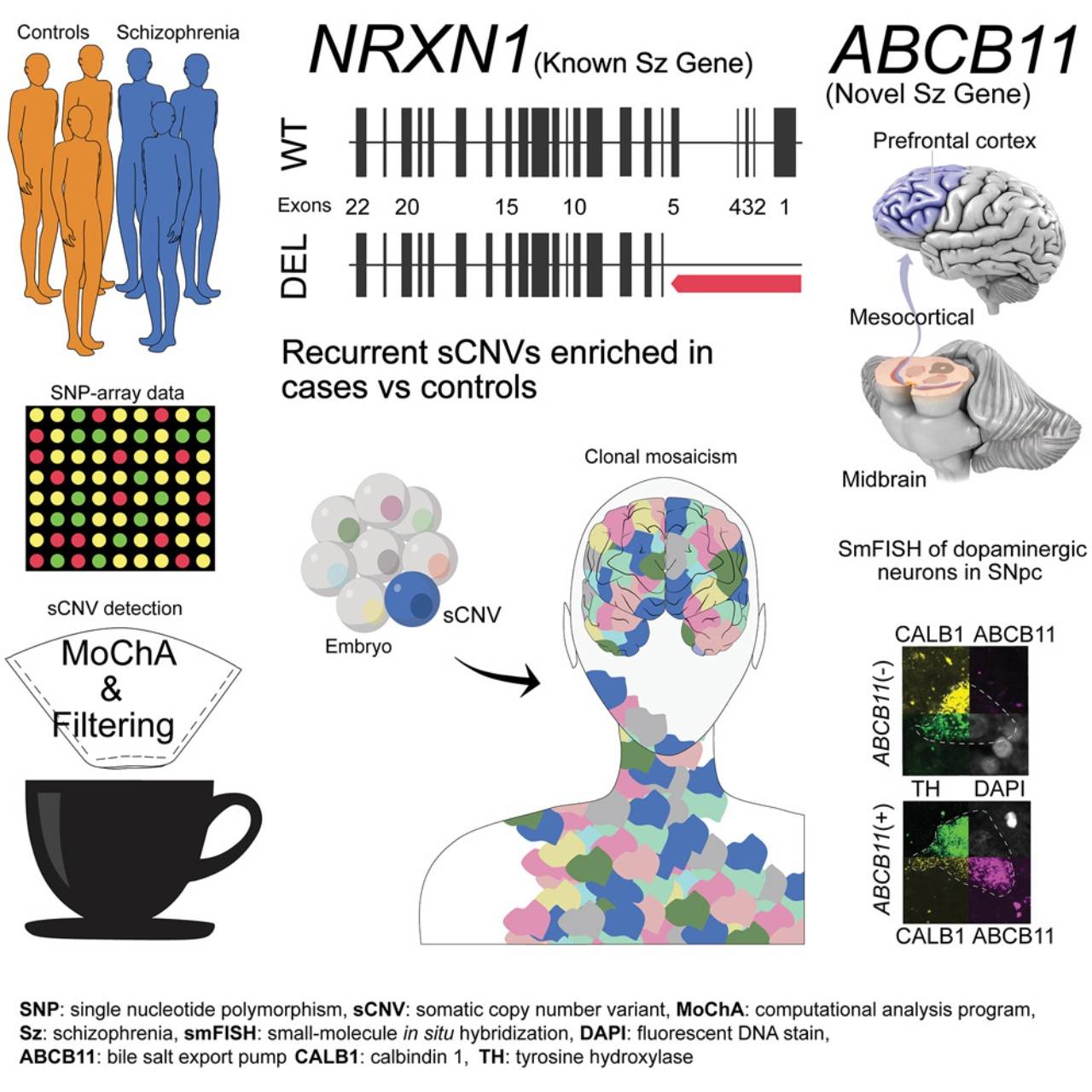
Las variaciones somáticas del número de copias asociadas a la esquizofrenia en 12.834 casos revelan alteraciones recurrentes en NRXN1 y ABCB11. / Cell Genomics / Maury et al.
El autor detalla que “los eventos específicos descriptos (NRXN1 y ABCB11) podían observarse en más del 10 % de las células”, lo que les convenció de que estas mutaciones “ocurren en alguna etapa muy temprana y, por lo tanto, estarían presentes en todos los tejidos, incluido el cerebro, ya que las células cerebrales se separan de la sangre mucho más tarde”.
Acerca de cómo llegaron a observar este vínculo, el investigador del Hospital Infantil de Boston reseña: “Hemos descubierto en otros trastornos, como la epilepsia pediátrica, la epilepsia del adulto y los trastornos del espectro autista, que una parte de los pacientes son portadores de estas mutaciones en algunas células, pero no en todas, lo que se conoce como mutaciones somáticas. En el caso de la epilepsia pediátrica resistente a tratamientos que acaba siendo derivada a neurocirugía, estas mutaciones somáticas son, en realidad, la causa más común”.
Con la experiencia adquirida, esta vez analizaron “un tipo concreto de mutación dañina, como son las denominadas variaciones del número de copias (CNV, por sus siglas en inglés), en las que un cromosoma gana o pierde un segmento de ADN, lo que da lugar a copias adicionales o a la pérdida de una copia de uno o varios genes”, en palabras de Walsh.
El método empleado para examinarlas, según indica el investigador, fue el “desarrollado para estudiar las primeras fases del cáncer de sangre, que puede estar causado por este tipo de variación CNV que se limitan a la sangre”. Pero “descartamos los cambios que se sabe que están asociados a trastornos sanguíneos, lo que reveló un número menor de fenómenos que están presentes en un mayor número de células: esto sugiere que se produjeron antes y que serían compartidos entre la sangre y el cerebro”.
El segundo gen identificado por los autores, el ABCB11, es más conocido por codificar una proteína hepática. “Ese gen surgió de la nada”, expone Eduardo Maury, estudiante de doctorado en Medicina del programa Harvard-MIT. “Ha habido algunas investigaciones que asociaron mutaciones en este gen con la esquizofrenia resistente a los tratamientos, pero no se había implicado fuertemente en la esquizofrenia en sí misma”, destaca.
Cuando el equipo indagó más a fondo, descubrió que ABCB11 también se expresa en subconjuntos muy específicos de neuronas que transportan dopamina desde el tronco encefálico hasta la corteza cerebral. Se cree que la mayoría de los fármacos contra la esquizofrenia actúan sobre estas células para disminuir los niveles de dopamina de un individuo, por lo que esto podría explicar por qué el gen está asociado con la resistencia a los tratamientos.
Más allá de estos hallazgos, el estudio abre la puerta a continuar identificando otras mutaciones adquiridas que podrían estar conectadas con la esquizofrenia. Los expertos indican que, dado que el estudio analizó muestras de sangre, será importante examinar más mutaciones específicas del cerebro que podrían haber sido demasiado sutiles o recientes en la vida de un paciente para que este análisis las detectara. Además, las alteraciones o duplicaciones somáticas podrían ser un factor de riesgo para investigar en asociación con otras patologías, sugieren.
“Con este estudio demostramos que es posible encontrar variantes somáticas en un trastorno psiquiátrico que se desarrolla en la edad adulta”, destaca Maury, “y esto despierta interrogantes sobre qué otros desórdenes podrían estar regulados por este tipo de mutaciones”.
Referencia:
Maury et al. “Schizophrenia-associated somatic copy number variants from 12,834 cases reveal recurrent NRXN1 and ABCB11 disruptions”. Cell Genomics (2023).