Un grupo de investigación de EE UU ha utilizado la tecnología de edición genética para crear un dispositivo, que permite a los usuarios detectar la presencia del virus SARS-CoV-2 y sus variantes en la saliva de forma muy eficaz y a un bajo coste. El diagnóstico se obtiene en una hora en una aplicación móvil y sin usar material de laboratorio.
Con la variante delta copando la mayoría de nuevos casos de COVID-19 detectados en el mundo, y a pesar de los altos ritmos de vacunación en los países desarrollados, la pandemia está lejos de terminar.
A lo largo de este año, los equipos de detección rápida del virus han experimentado un rápido avance, pero aún así, la mayoría de las muestras de pacientes aún han de ser llevadas a un laboratorio —especialmente para detectar variantes— con el consecuente gasto de tiempo y recursos.
En un artículo publicado en la revista Science Advances, un equipo del Wyss Institute for Biologically Inspired Engineering de Harvard, el Instituto Tecnológico de Massachusetts (MIT) y varios hospitales del área de Boston, presentan el diseño de un dispositivo de diagnóstico de bajo coste basado en la técnica de edición genética CRISPR, que permite a los usuarios detectar la presencia del SARS-CoV-2 y sus múltiples mutaciones usando una muestra de su saliva.
El dispositivo se llama miSHERLOCK y los creadores aseguran que detecta el virus y distingue entre tres tipos de mutación. También puede ser reconfigurado para detectar una cuarta —la delta—. El diagnóstico se obtiene en una hora, con una aplicación móvil, y sin usar material de laboratorio.
Según explica Helena de Puig, investigadora del Wyss Institute y coautora del estudio, “miSHERLOCK elimina la necesidad de trasportar las muestras de los pacientes a un laboratorio, y simplifica enormemente todo el proceso de detección y análisis, algo crítico durante una pandemia”.
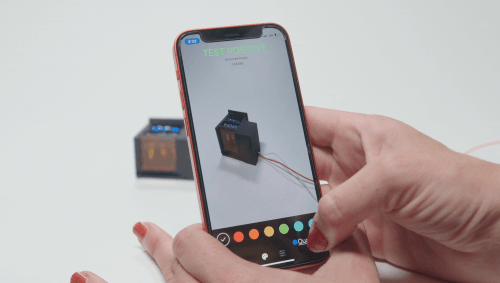
Puedes usar una aplicación móvil para saber si eres positivo. / Wyss Institute of Harvard
El dispositivo se ha construido usando impresión 3D y otros componentes fácilmente accesibles y permite simplificar los pasos para obtener un dictamen.
Otra de las autoras del artículo es Rose Lee, profesora de pediatría en el Hospital infantil de Boston, además de especialista en enfermedades infecciosas. Sus experiencias en primera línea durante la pandemia le han servido de inspiración para crear este instrumento de detección.
"Cosas que solían ser de fácil acceso en el hospital, como los hisopos nasofaríngeos, eran de repente difíciles de conseguir, y los procedimientos rutinarios de procesamiento de muestras se veían alterados, un gran problema en un entorno pandémico", afirma Lee. "Nuestro objetivo era eliminar estos cuellos de botella y proporcionar diagnósticos precisos de la covid-19 sin depender de las cadenas de suministro, e incluso detectar con precisión las variantes que estaban empezando a surgir".
Para la detección del virus, el equipo recurrió a una tecnología denominada desbloqueo enzimático específico de alta sensibilidad (SHERLOCK), basada en la herramienta de edición genética CRISPR y creada por el investigador del Instituto Wyss, Jim Collins, autor senior del estudio.
SHERLOCK usa las tijeras moleculares para cortar el ADN o ARN del objetivo en lugares concretos. Los investigadores crearon una reacción SHERLOCK diseñada para cortar el ARN del SARS-CoV-2 en una región de un gen llamada nucleoproteína que se ha observado en múltiples variantes del virus.
Cuando la tijera molecular —una enzima llamada Cas12a— se une con éxito al gen de la nucleoproteína presente en el virus y lo corta, se produce una señal fluorescente. El equipo ha diseñado otros test SHERLOCK, cuyo objetivo es adherirse y detectar la espícula de tres de las variantes del SARS-CoV-2: alfa, beta y gamma.
"Cuando se analiza una muestra en busca de ácidos nucleicos –como el ADN o el ARN–, hay que ser cuidadosos para no contaminarla, lo que para una persona no formada, puede resultar difícil. Para que esta prueba diagnóstica fuera realmente fácil de usar, había que simplificar el proceso todo lo posible" afirma Xiao Tan, investigador en el Instituto Wyss y profesor en el Hospital General de Massachusetts.
El equipo decidió utilizar muestras de saliva en lugar de hisopos nasofaríngeos, porque es más fácil para los usuarios recoger saliva y los estudios han demostrado que el SARS-CoV-2 es detectable en este fluido durante un mayor número de días después de la infección. Aun así, la saliva no procesada presenta sus propios desafíos: contiene enzimas que degradan varias moléculas, lo que produce una alta tasa de falsos positivos.
Los investigadores desarrollaron una técnica para resolver este problema: añadieron a la saliva dos sustancias químicas denominadas DTT y EGTA y calentaron la muestra a 95 °C durante 3 minutos, lo que eliminó la señal de falso positivo de la saliva no tratada.
Para integrar el recipiente de saliva y la reacción SHERLOCK en un solo elemento, el equipo diseñó un sencillo dispositivo alimentado por pilas con dos cámaras: una cámara de preparación de la muestra calentada y otra de reacción.
Para proceder al análisis, el usuario escupe en la cámara de preparación de la muestra, enciende la resistencia y espera de tres a seis minutos para que la saliva sea absorbida por el filtro. Luego, retira el filtro y lo transfiere a la columna de la cámara de reacción, empuja un émbolo que deposita el filtro en la cámara y perfora un depósito de agua para activar la reacción SHERLOCK.
Una hora después, el usuario puede confirmar si es positivo si detecta una florescencia en la muestra a través de una ventana tintada.
También puede utilizar una aplicación para móvil que analiza los píxeles registrados por la cámara para proporcionar un diagnóstico positivo o negativo.
Según el artículo, los investigadores determinaron una tasa de efectividad en la detección de un 96 % en los casos positivos, y un 95 % en los negativos.
También probaron su rendimiento contra las variantes alfa, beta y gamma del SARS-CoV-2 con éxito.
"Una de las grandes ventajas de miSHERLOCK es que es totalmente modular, por lo que se puede reconfigurar para la secuencia específica de ARN o ADN que se está tratando de detectar", según Devora Najjar, asistente de investigación en el MIT Media Lab y en el Collins Lab.
"El dispositivo cuesta unos 15 dólares, pero la producción en masa reduciría la carcasa a unos 3 dólares. Los ensayos para nuevos virus pueden crearse en unas dos semanas, lo que permitiría el rápido desarrollo de pruebas para nuevas variantes de la COVID-19 y otras enfermedades”.
Este test está diseñado para ser usado en lugares con pocos recursos, ya que solo se necesita una impresora 3D y el diseño de la circuitería está publicado en internet. El uso de una aplicación móvil para realizar el diagnóstico también está enfocado a este tipo de regiones, que tienen poca capacidad para acceder a elementos de detección más sofisticados.
Referencia:
De Puig, Collins et al. "Minimally Instrumented SHERLOCK (miSHERLOCK) for CRISPR-based Point-of-Care Diagnosis of SARS-CoV-2 and Emerging Variants". Science Advances, 2021