Una mutación en las células beta pancreáticas genera una cadena de fallos en la producción de insulina, lo que favorece la hiperglucemia crónica. Los hallazgos proponen nuevas vías terapéuticas para esta condición metabólica.
Existe un gen llamado HNF1A que, si tiene unas mutaciones específicas, se produce una forma rara y de aparición temprana de diabetes, llamada MODY3. Pero también existen alteraciones frecuentes en este gen, en menor escala, y que predisponen a millones de personas a desarrollar diabetes tipo 2. Un estudio liderado por un equipo del Centro de Regulación Genómica de Barcelona (CRG) desvela la razón de este fenómeno.
El estudio, publicado en Cell Metabolism, desvela que la raíz del problema se encuentra en las células beta pancreáticas productoras de insulina.
Así lo demostraron los resultados, donde los niveles de glucosa en sangre en ratones solo se modificaban cuando se eliminaba el gen HNF1A de las células beta, y no cuando se hacía en células de hígado o intestino.
Según explica a SINC el líder del estudio e investigador del CRG, Jorge Ferrer, en un páncreas sano, por cada célula beta que funciona lentamente produciendo insulina, hay otra que lo hace bien y rápido. Pero en un paciente de diabetes tipo 2, ese equilibrio se rompe y por cada “buena” hay ocho que no responden de una manera óptima.
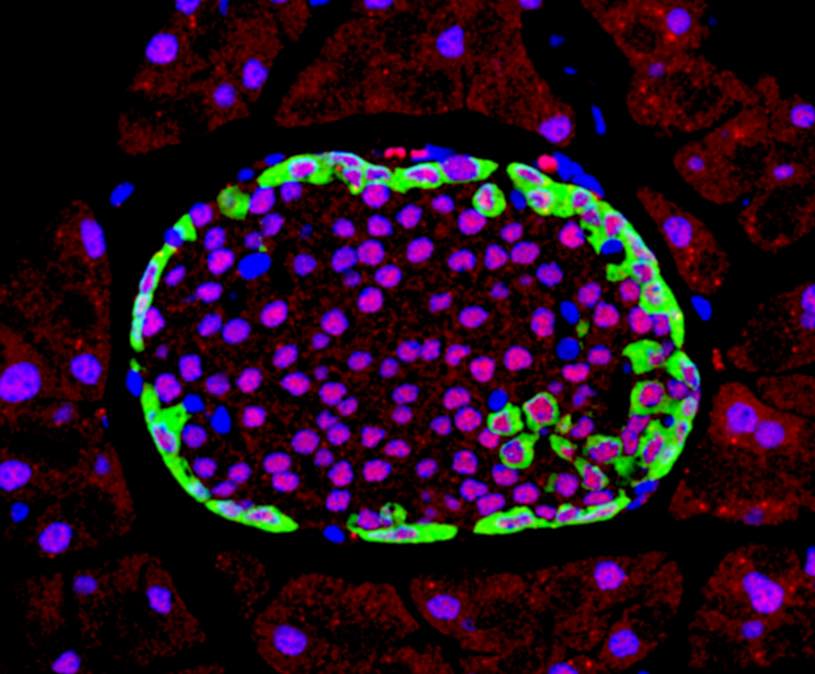
Sección de tejido pancreático. / Miguel Angel Maestro Garriga (CRG)
“Esta pérdida de capacidad funcional se traduce en menos insulina disponible cuando sube la glucosa, lo que favorece la hiperglucemia crónica”, argumenta el experto.
HNF1A es un factor de transcripción, es decir, su función consiste en unirse al ADN y ajustar la expresión de otros genes. Al suprimirse en las células beta humanas o murinas, los científicos descubrieron que afecta a la activación de un centenar de genes, muchos de los cuales codifican moléculas necesarias para el transporte y la liberación de insulina, según indica el estudio.
Asimismo, otro de los objetivos de este gen es la producción de A1CF encargado de ensamblar –splicing en inglés– el ARN antes de introducirse en las proteínas.
“Cuando HNF1A falla, ya sea por mutaciones raras o por variantes comunes que lo hacen trabajar a medio gas, la producción de A1CF cae en picado y eso dispara los errores de ensamblaje en cientos de ARN mensajeros”, explica Ferrer. También vieron que se podían acumular entre 1 900 y 2 3000 errores de splicing diferentes.
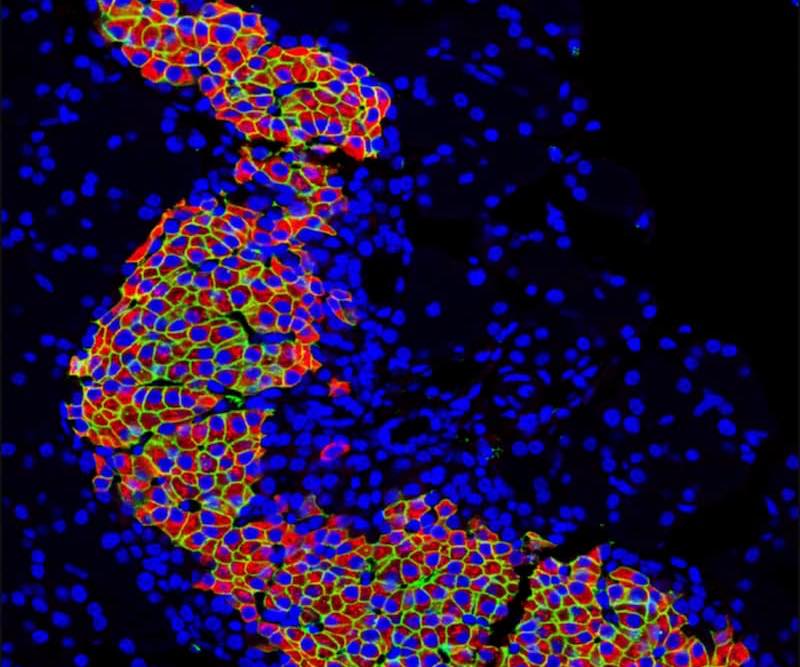
Imagen de un islote pancreático /Miguel Angel Maestro Garriga (CRG)
El funcionamiento correcto de ambos genes importa, afirma otro autor del estudio e investigador del CRG, Matías Gonzalo de Vas. “El primer golpe es más amplio y prepara el terreno, mientras que el segundo añade disfunción adicional, expresa el científico sobre la producción de HNF1A y A1CF, respectivamente.
El análisis de células pancreáticas humanas ilustró un panorama similar. En donantes sanos se observó una población robusta de células β con elevada actividad de HNF1A y A1CF, mientras que en donantes con diabetes tipo 2 se detectó un aumento significativo de poblaciones celulares con baja actividad de ambos genes.
Estos resultados ofrecen nuevas dianas terapéuticas tanto para la diabetes monogénica –que afecta al 0,03 % de la población– como para la diabetes tipo 2, una enfermedad metabólica con la que convive uno de cada nueve adultos y afecta a 600 personas en todo el mundo.

Las anomalías de ARN que hemos encontrado son subsanables y ofrecen un objetivo claro, algo poco habitual en una enfermedad increíblemente compleja

“Las terapias existentes para la diabetes disminuyen la glucemia sin corregir los defectos subyacentes”, explica Ferrer. “Las anomalías de ARN que hemos encontrado son subsanables y ofrecen un objetivo claro, algo poco habitual en una enfermedad increíblemente compleja”, argumenta.
Según sus hallazgos y aunque esta enfermedad metabólica se relacione en gran medida con el estilo de vida, los investigadores afirman que estas mutaciones contribuyen de una forma “causal” a su inicio. Por ello, ahora planean identificar todas las proteínas y moléculas de ARN susceptibles de convertirse en vías para el tratamiento.
Referencia:
Bernardo. et al. HNF1A and A1CF coordinate a beta cell transcription-splicing axis that is disrupted in type 2 diabetes. Cell Metabolism. 2025.