Dos equipos del CSIC colaboran para mejorar la eficacia de los medicamentos contra tumores y enfermedades autoinmunes. Para ello, desarrollan nanopartículas de óxido de hierro que podrán transportar los fármacos y actuar de manera localizada en el cuerpo del paciente, asegurando tratamientos personalizados con menos efectos secundarios que los actuales.
En la actualidad, se tiende hacia una medicina más personalizada, con tratamientos dirigidos y en los que se tengan en cuenta lo que diferencia a cada paciente, desde sus genes hasta su estilo de vida. En este sentido, el mundo de lo ‘nano’ está ganando peso; las técnicas de nanotecnología son una de las vías que se están explorando con el fin de combatir enfermedades, al tiempo que se minimiza su impacto en los tejidos sanos del paciente.
En consonancia con este rumbo, muchos investigadores se han lanzado a idear y fabricar nanopartículas: estos pequeños vehículos serán los encargados de transportar los fármacos a determinada parte del cuerpo y liberarlos de forma programada.
En el campus de la Universidad Autónoma de Madrid (UAM), los laboratorios de Domingo Barber, en el Centro Nacional de Biotecnología) (CNB-CSIC) y María del Puerto Morales Instituto de Ciencia de Materiales de Madrid (ICMM-CSIC) trabajan codo con codo para desarrollar unas nanopartículas de óxido de hierro capaces de tratar el cáncer. Su objetivo es conocer a la perfección la naturaleza de cada partícula y qué aspectos de su diseño tienen implicaciones en su comportamiento, algo vital para aplicar estas técnicas en pacientes reales en el futuro.
Cuesta imaginar lo pequeña que es una nanopartícula. Para empezar, estos objetos no suelen propasar los 100 nanómetros, o lo que es lo mismo, la milmillonésima parte de un metro. Es su tamaño lo que permite que puedan ser utilizadas en una gran variedad de aplicaciones, desde la agricultura hasta la electrónica pasando por la óptica.

Nuestra partícula es una esfera de óxido de hierro sólida. Aprovechamos su superficie para recubrirla con polímeros (moléculas grandes) y otras moléculas y transportar el fármaco que se va a encargar de tratar el tumor

En el campo de la biomedicina, estas partículas se utilizan actualmente en algunas prácticas como las resonancias magnéticas o los contrastes. También han ganado relevancia en las áreas de la oncología y la inmunología, pero para que su uso en clínica se convierta en una práctica segura es necesario comprender cómo interaccionan las partículas con nuestro cuerpo. Esto es precisamente lo que estudia el grupo de Domingo Barber en el CNB.
“Nuestra partícula es una esfera de óxido de hierro sólida. Aprovechamos su superficie para recubrirla con polímeros (moléculas grandes) y otras moléculas y transportar el fármaco que se va a encargar de tratar el tumor”, señala Barber.
Lo que ha observado el equipo del CNB es que la composición del recubrimiento afecta a la rapidez y la forma en que la nanopartícula se degrada. Este conocimiento podrá usarse en el futuro para desarrollar tratamientos diferentes dependiendo del tipo de cáncer que se quiera tratar, el método que vaya a utilizarse y la localización del tumor.
Hacer llegar una nanopartícula a una parte específica del cuerpo podría parecer sencillo, pero lo cierto es que las condiciones que se recrean en un laboratorio son una idealización. La realidad es mucho más compleja y está condicionada por muchos más factores: la sangre tiene un flujo y está repleta de proteínas, lípidos y otras sustancias orgánicas que interaccionan con las partículas. Con ello en mente, los científicos del CNB comenzaron a explorar las diferentes opciones para hacer frente a todos estos retos.
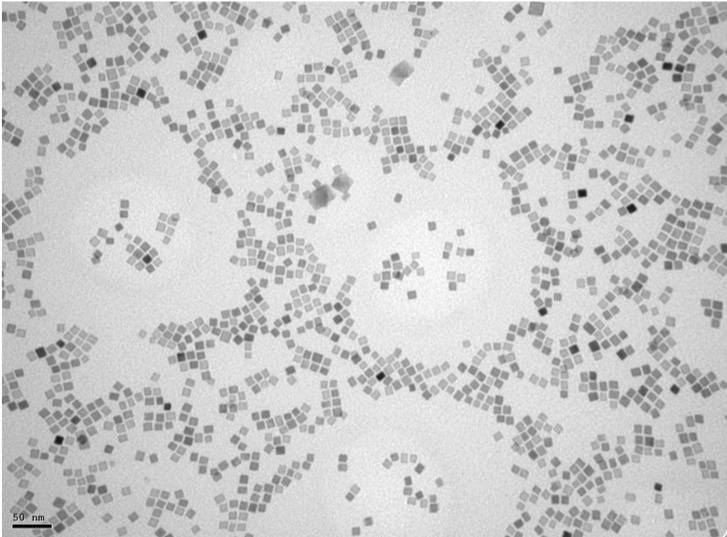
Nanopartículas de óxido de hierro de 12 nm con forma cúbica. Fotografía realizada con un microscopio electrónico de transmisión, que utiliza un haz de electrones en lugar de luz. / Imagen cedida por David Egea / CNB-CSIC
Una de las estrategias que podía seguir el grupo era aprovecharse de la retención pasiva. Este fenómeno es la consecuencia de que los endotelios (capas que separan los tejidos de la sangre para regular su flujo) de las zonas con tejidos inflamados y tumorales tengan un tamaño de poro más grande. Debido a ello, cuando introduces nanopartículas en un ratón y dejas pasar un tiempo suficiente estas se acaban acumulando en los tejidos inflamados de manera natural.
Esa fue la propuesta inicial del grupo: ver si eran capaces de insertar unas citoquinas llamadas interferón gamma en las nanopartículas y dejar que la retención pasiva actuase. Estas proteínas, que forman parte del sistema inmunitario, tienen como función activar a los macrófagos, células especializadas en detectar cualquier organismo dañino para el cuerpo, incluidas las células cancerígenas.
Además, aumentan la acumulación de los macrófagos en la zona donde se encuentra la proteína, facilitando que se produzca la respuesta del sistema inmune adaptativo en el tumor. Así, las células cancerígenas son eliminadas por nuestro propio cuerpo.

Una posibilidad poco explorada es desarrollar nanopartículas magnéticas y colocar sobre la piel un imán que genere un campo magnético capaz de atraerlas al tejido dañado

“Pensamos que sería interesante utilizar partículas de algún material que permitiera aplicar técnicas físicas complementarias a la retención pasiva”, resume Barber. Y “había una posibilidad poco explorada: desarrollar nanopartículas magnéticas y colocar sobre la piel un imán que generase un campo magnético capaz de atraerlas al tejido dañado”, explica.
El investigador indica que “una vez se introducen en la sangre las partículas comienzan a circular por el organismo rápidamente. Gracias al imán, conseguimos retenerlas más tiempo en la zona donde lo hemos colocado y así, en parte por esta atracción magnética y en parte por la retención pasiva, facilitamos que la nanopartícula interaccione con la célula y se activen ciertos mecanismos esenciales para que el contenido de nuestra partícula sea absorbido por esta”.
Sin embargo, esta no es la única razón por la cual el grupo decidió usar óxido de hierro. Además de tener propiedades magnéticas, las investigaciones de este grupo indican que estas partículas desaparecen con el tiempo sin producir daños en el organismo.
Según Barber, “nuestro cuerpo tiene un mecanismo muy fino para la regulación del hierro. Cuando se produce un exceso este se acumula en el bazo y el hígado, ya que en estos órganos hay unos macrófagos especializados en captar el hierro de los glóbulos rojos”. El recubrimiento de las nanopartículas también condiciona si estas se acumulan en un órgano u otro, influyendo por tanto en la rapidez con la que terminan siendo eliminadas por completo.
Yadileiny Portilla investiga en su tesis las interacciones entre organismo y partículas. Con respecto a la degradación de las partículas, Portilla considera importante “entender todos los procesos de absorción, ya que esto es lo que ayuda la hora de jugar con las terapias personalizadas”, recalca.
En su estudio, Portilla vio que si utilizaba un tipo concreto de recubrimiento (DMSA), aumentaba la cantidad de nanopartículas que se acaban acumulando en el hígado. De este modo, “si en el futuro tratamos a un paciente que además de cáncer sufre algún problema hepático sabemos que debemos aplicarle a nuestra nanopartícula otro recubrimiento diferente, que se acumule menos”, detalla.
Portilla destaca además la necesidad de estudiar la toxicidad de las nanopartículas a largo plazo, ya que “es natural que cuando vas a recibir cualquier tipo de tratamiento surjan dudas y temores. ¿Qué va a pasar con ese fármaco una vez esté dentro de mi cuerpo?”.
Su trabajo de tesis muestra que en un período de un año y tres meses las nanopartículas que se habían introducido en el organismo de ratones y que se habían acumulado en el hígado se degradaban por completo, de modo que confía en que el óxido de hierro no presente problemas de salud en el caso de los humanos más allá de una subida puntual en los niveles de transaminasas del hígado.
Las nanopartículas de óxido de hierro ya han sido aprobadas por entidades como la Administración de Alimentos y Medicamentos de EE UU (FDA) para su uso en pacientes con enfermedades como la anemia, algo que sin duda demuestra la viabilidad de trasladar esta tecnología, fruto de la investigación básica, a casos de pacientes reales en la clínica.
El recubrimiento de la nanopartícula no solo va a afectar a la rapidez con la cual esta se degrada o los órganos en los cuales se acumula. Una vez entra en nuestra sangre, la partícula comienza a interactuar con una serie de biomoléculas, aumentando su tamaño y variando su carga eléctrica. Cuando los investigadores diseñan una partícula con un fin específico no pueden obviar esta interacción que tiene como resultado la formación de la llamada corona proteica, de ahí que dediquen parte de su trabajo a comprender cómo varía esta dependiendo de su recubrimiento inicial.
“En algunos casos —comenta Portilla— el tamaño de la partícula aumenta poco, como ocurre con un recubrimiento llamado DMSA. Sin embargo, cuando utilizamos una cobertura distinta, por ejemplo de APS, nuestra nanopartícula puede incrementar su tamaño hasta diez veces. Tenemos que tener en cuenta la corona proteica, si no podríamos estar diseñando un tratamiento de carga positiva que una vez se introduce en el flujo sanguíneo cambia de carga”.
En el Instituto de Ciencia de Materiales de Madrid, María del Puerto Morales se encarga de dar forma a las nanopartículas de óxido de hierro que los investigadores del CNB utilizarán en los tratamientos contra el cáncer
“Utilizando un imán las puedo manipular y atraerlas, concentrando estas nanopartículas en una zona concreta. Sin embargo, cuando quitamos el imán pasan a comportarse como un líquido que forma parte de la sangre, de modo que es imposible que taponen tus venas”, señala esta científica.
Actualmente, el grupo del ICMM utiliza el proceso de la síntesis química para elaborar las nanopartículas. Sobre el método de fabricación, Morales comenta: ”En nuestro grupo tratamos de hacer esa síntesis utilizando agua en lugar de un medio orgánico, ya que mediante este último se generan muchos residuos”.
La idea del equipo es poder desarrollar una técnica basada en una química “más verde” y que sea reproducible en las salas blancas de los hospitales con el fin de facilitar el tratamiento personalizado en pacientes. Para ello, es necesario buscar una técnica sencilla y asequible pero que siga manteniendo buenos resultados.
“Hemos conseguido superar el primer reto”, comenta Morales, y es que este tipo de síntesis puede lograrse utilizando un microondas especializado dando lugar a nanopartículas que conservan sus propiedades pese a reducir el tiempo y la temperatura de la síntesis. Como cualquier tecnología, el abaratamiento de las partículas será una cuestión de tiempo.

David Egea estudia en el CNB el comportamiento de las nanopartículas magnéticas en presencia de un campo magnético. / Lucía Casas Piñeiro
Además de atacar los tumores activando la respuesta del sistema inmune, el grupo de Barber investiga otras posibilidades para frenar el cáncer, como la hipertermia magnética o el estrés oxidativo.
David Egea estudia en el CNB el comportamiento de las nanopartículas magnéticas en presencia de un campo magnético. ¿Cómo lo hace? Tomando como ejemplo la respuesta natural del cuerpo humano: “En general asociamos la fiebre como algo malo, pero en realidad esto quiere decirnos que nuestro sistema está reaccionando ante una enfermedad”, comenta el investigador.
Una de las consecuencias que se producen cuando una infección ataca al organismo es que el cuerpo aumenta su temperatura para inducir la muerte de bacterias y otros microorganismos, en general, más sensibles al calor. Egea sigue este mismo principio para tratar células cancerígenas.
Explica que “estas células tienen menos tolerancia a los cambios de temperatura que las células sanas por varios factores. La sangre, que actúa como un medio refrigerante, no tiene capacidad para acceder a las partes más profundas del tumor, dificultando que estas células cancerígenas mantengan una temperatura estable”.
En el campo de la nanotecnología, este investigador se sirve de una terapia experimental llamada hipertermia magnética; Egea hace uso de las nanopartículas de óxido de hierro, consideradas unas buenas candidatas para esta técnica ya que “los momentos magnéticos de las nanopartículas se orientan cuando existe un campo magnético alterno, generando un calor muy localizado en los tejidos inmediatamente próximos a la partícula”.
De este modo, “el aumento de la temperatura inducirá la muerte de la célula cancerígena sin afectar a los tejidos sanos de su alrededor”, subraya.
Otra de las líneas del laboratorio del CNB, encabezada por la investigadora Neus Daviu, se centra en el estrés oxidativo: en toda célula se produce constantemente energía necesaria para su funcionamiento. Las mitocondrias, que actúan como auténticas máquinas capaces de fabricar esta energía, generan como consecuencia de este proceso un oxígeno reactivo que puede oxidar y alterar el funcionamiento de otras partes de la célula como el ADN, las proteínas o los lípidos de la membrana celular.
Generalmente esto no ocurre, ya que las propias células tienen mecanismos antioxidantes que regulan la producción de oxígeno reactivo. Sin embargo, cuando estas defensas no son capaces de controlar la presencia de radicales libres se produce el estrés oxidativo, un desequilibrio en el interior de la célula mediante el cual se genera el envejecimiento de esta y su posterior muerte.
La investigadora explica: “El caso de las células tumorales es distinto; son energéticamente muy activas, ya que necesitan reproducirse más rápido. ¿Cómo lo hacen? Utilizan constantemente un metabolismo rápido, que genera poca energía en muy poco tiempo. Al ser tan activas producen estrés oxidativo, que por otra parte no se compensa con las defensas antioxidantes ya que estas están alteradas por mutaciones”.

Podemos ralentizar el metabolismo de la célula para impedir que crezca y migre a otras partes del cuerpo, evitando la metástasis, o bien llevar al límite a la célula tumoral aumentando su estrés oxidativo

Daviu se basa en este desequilibrio natural para atacar al cáncer utilizando las nanopartículas de óxido de hierro. Y puede hacerlo de distintas maneras: “Podemos ralentizar el metabolismo de la célula para evitar que crezca y migre a otras partes del cuerpo, evitando la metástasis, o bien llevar al límite a la célula tumoral aumentando su estrés oxidativo”, resume la investigadora. También ha observado que incluso el recubrimiento de la nanopartícula de hierro afecta al estrés oxidativo de la célula dependiendo, por ejemplo, de su carga.
Además de centrarse en las células cancerígenas, Daviu observa su microambiente. En las inmediaciones de un tumor siempre hay células endoteliales, que aportan los nutrientes necesarios para el funcionamiento de cualquier célula. También hay células del sistema inmunitario, como los macrófagos.
“Puedo estudiar cómo afecta el estrés oxidativo a estas otras células y actuar sobre ellas. Podemos activar aún más la respuesta del sistema inmunitario induciendo una mayor actividad de los macrófagos. También, minimizar la actividad de las células endoteliales para que no lleguen nutrientes al tumor. Así, la suma de todas estas acciones sí podría suponer la muerte de las células cancerígenas", detalla la científica.
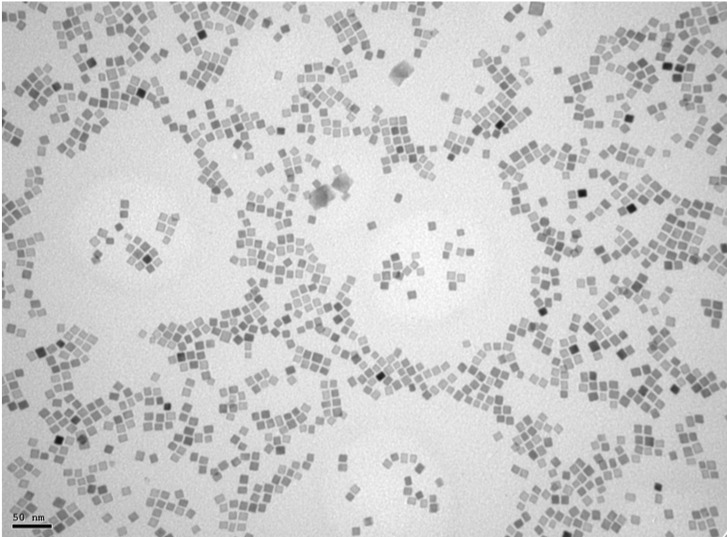
Fotografía de nanopartículas de óxido de hierro de 14 nm con forma octaédrica realizada con un microscopio electrónico de transmisión. / Imagen cedida por David Egea / CNB-CSIC
Hace tan solo veinte años parecía impensable lograr el nivel de precisión que la biomedicina muestra a día de hoy. Las terapias dirigidas y los tratamientos especializados muestran un futuro prometedor para la ciencia y para la calidad de vida de los pacientes oncológicos, que podrán prescindir cada vez más de los tratamientos generalizados y sus nocivos efectos secundarios.
En este sentido, el trabajo de los laboratorios de Domingo Barber y María del Puerto Morales son el vivo ejemplo de la necesidad de tener una investigación básica que nos ayude a comprender mejor los mecanismos del cuerpo humano en un sentido transversal. Un espacio donde la única forma de avanzar es eliminar la barrera entre disciplinas como la química, la medicina, la física y la biología y entender que, a veces, las pequeñas soluciones pueden ser la mejor respuesta a un enorme problema.
Este reportaje ha sido realizado dentro del programa de ayudas CSIC-FBBVA Comunicación Científica.