Insertar, invertir o eliminar secuencias largas de ADN en posiciones específicas del genoma de bacterias es posible gracias a una nueva herramienta que utiliza los llamados ‘puentes de ARN’. Esta estrategia ofrece un corta-pega más eficiente, en comparación con los métodos actuales. Sin embargo, aún no se ha demostrado que el sistema funcione en células humanas.
En 2015, las tijeras moleculares CRISPR Cas9 fueron consideradas el mayor avance científico del año. Desde entonces, esta herramienta se ha usado sin descanso en el laboratorio para cambiar o editar piezas del ADN de una célula, con numerosas aplicaciones terapéuticas. Cinco años después, las codescubridoras de esta tecnología recibieron el Nobel de Química por este hallazgo.
Esta semana, en un salto adelante para la ingeniería genética, un equipo de investigadores de EE UU y Japón han descubierto un nuevo método -más preciso y potente, según sus creadores- para recombinar y reorganizar el ADN de forma programable. Los resultados se publican hoy en dos estudios de la revista Nature.
En el primero de ellos, se desvela esta nueva clase de sistemas biológicos programables. El ARN puente es el primer ejemplo de una guía de ARN específica, capaz de reconocer y unirse simultáneamente a secuencias de ADN diana y donante.
“Esta propiedad única nos permite no solo insertar, sino también eliminar e invertir de forma programable dos fragmentos cualesquiera de ADN utilizando un único mecanismo unificado”, explica a SINC Patrick Hsu, autor principal del trabajo e investigador del Instituto Arc (Palo Alto, EE UU).
“Aunque la recombinación puente representa un avance significativo más allá de las capacidades de corte de ADN y ARN de anteriores tecnologías y nos acerca a un conjunto completo de capacidades de diseño del genoma, es pronto para compararlo con los sistemas CRISPR altamente optimizados”, añade el experto.
“Eso sí, nuestros resultados iniciales en células bacterianas son prometedores. Hemos demostrado una eficacia de inserción entre el 60 % y el 90 % de un gen deseado en células bacterianas, dependiendo del ARN puente utilizado. También conseguimos una especificidad de inserción superior al 94 % en el genoma de E. coli”, continúa.

Esta propiedad única nos permite no solo insertar, sino también eliminar e invertir de forma programable dos fragmentos cualesquiera de ADN utilizando un único mecanismo unificado

Los sistemas de ARN puente se encuentran en bacterias y arqueas, y los investigadores han mostrado una versión de este sistema in vitro y en células bacterianas. Su posible aplicación en células y genomas de mamíferos podría beneficiar a una amplia gama de organismos utilizados en investigación y biotecnología.

El equipo del primer estudio publicado en Nature: Januka Athukoralage, Nicholas Perry, Silvana Konermann, Matthew Durrant, Patrick Hsu, James Pai y Aditya Jangid. / Ray Rudolph
Una ventaja potencial del ARN puente es que puede realizar la recombinación sin necesidad de los mecanismos de reparación del ADN del huésped, lo que supondría una edición más precisa. También tiene la capacidad única de reconocer y manipular dos secuencias de ADN simultáneamente, abriendo nuevas posibilidades que no son fáciles de conseguir con los sistemas CRISPR actuales.
“Estamos entusiasmados con las muchas aplicaciones posibles que tenemos por delante”, señala Hsu. “Por ejemplo, algún día se podrían modificar simultáneamente conjuntos enteros de variantes genéticas, lo que permitiría investigar factores de riesgo poligénicos en lugar de cambiar variantes individuales de una en una”.
Para Hsu, el ARN puente también podría acelerar la ingeniería metabólica en la biología procariota insertando vías enzimáticas completas para producir compuestos valiosos.
De la misma forma, en terapia génica y celular, este mecanismo facilitaría la inserción de grandes construcciones genéticas, como los receptores quiméricos de antígenos para la inmunoterapia del cáncer o los genes ausentes para la terapia génica en regiones genómicas específicas, y mejorar la eficacia y seguridad de dichos tratamientos.
También hay muchas aplicaciones genómicas funcionales, entre ellas las posibilidades de enfermedades causadas por expansiones repetidas o translocaciones genéticas que podrían abordarse al extirpar o invertir con precisión los segmentos de ADN problemáticos, lo que permitiría a los científicos centrarse en las anomalías genéticas.
El sistema de recombinación puente procede de los elementos de la secuencia de inserción 110 (IS110), uno de los innumerables tipos de elementos transponibles -o ‘genes saltarines’- que se cortan y pegan a sí mismos para moverse dentro de los genomas microbianos y entre ellos.
Los elementos transponibles se encuentran en todas las formas de vida y han evolucionado hasta convertirse en máquinas profesionales de manipulación del ADN para sobrevivir.
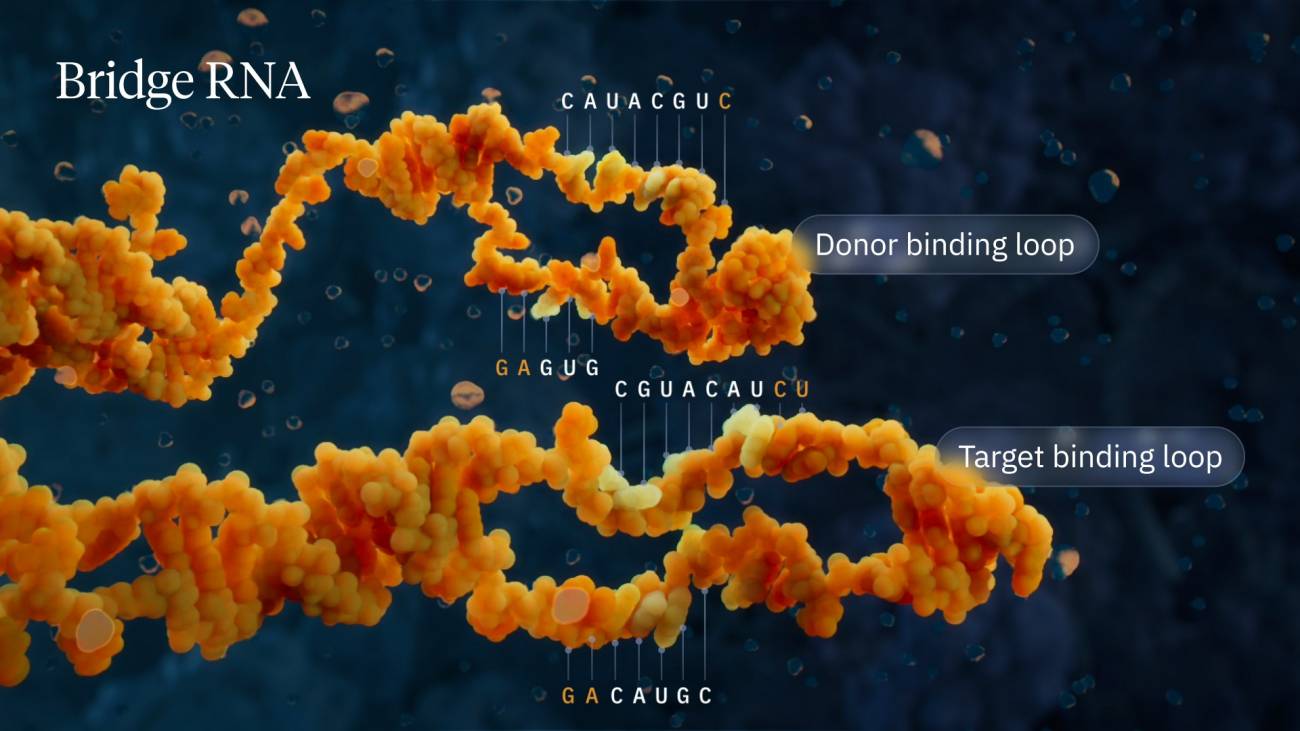
Visualización del mecanismo de la recombinasa puente destacando los bucles de unión donante y diana. / Visual Science
Los elementos IS110 son mínimos y constan únicamente de un gen que codifica la enzima recombinasa y de segmentos de ADN flanqueantes, que hasta ahora eran un misterio.
El laboratorio de Hsu descubrió que cuando el IS110 se extirpa de un genoma, los extremos del ADN no codificante se unen para producir una molécula de ARN –el ARN puente– que se pliega en dos bucles. Uno de ellos se une al propio elemento IS110, mientras que el otro se une al ADN diana donde se insertará el elemento.
El ARN puente es el primer ejemplo de molécula guía biespecífica, que establece la secuencia tanto del ADN diana como del donante mediante interacciones de apareamiento de bases.
Cada bucle del ARN puente es programable de forma independiente, lo que permite a los investigadores mezclar y combinar cualquier secuencia de ADN diana y donante de su interés.
Esto significa que el sistema puede ir mucho más allá de su función natural de inserción del elemento IS110, permitiendo la inserción de cualquier carga genética deseable -como una copia funcional de un gen defectuoso causante de una enfermedad- en cualquier localización genómica.
El descubrimiento del laboratorio de Hsu se complementa con su colaboración con el grupo de Hiroshi Nishimasu, de la Universidad de Tokio, cuyos resultados se publican en un segundo trabajo en Nature.
El equipo utilizó la criomicroscopía electrónica para determinar las estructuras moleculares del complejo ARN puente de la recombinasa unido al ADN diana y al donante, avanzando secuencialmente por los pasos clave del proceso de recombinación.
La idea es que el mecanismo puente marque el comienzo de una tercera generación de sistemas guiados por ARN, y vaya más allá de los mecanismos de corte de ADN y ARN de CRISPR y ARN de interferencia (ARNi) para ofrecer un mecanismo unificado de reordenación programable del ADN.
“Hasta ahora se desconocía cómo la recombinasa IS110 y el ARN puente trabajan juntos para mediar en la recombinación del ADN”, apunta a SINC Nishimasu. “Para comprender este mecanismo sin precedentes, utilizamos la criomicroscopía electrónica para observar la estructura atómica del complejo que incluye la recombinasa IS110, el ARN puente, el ADN donante y el ADN diana”.
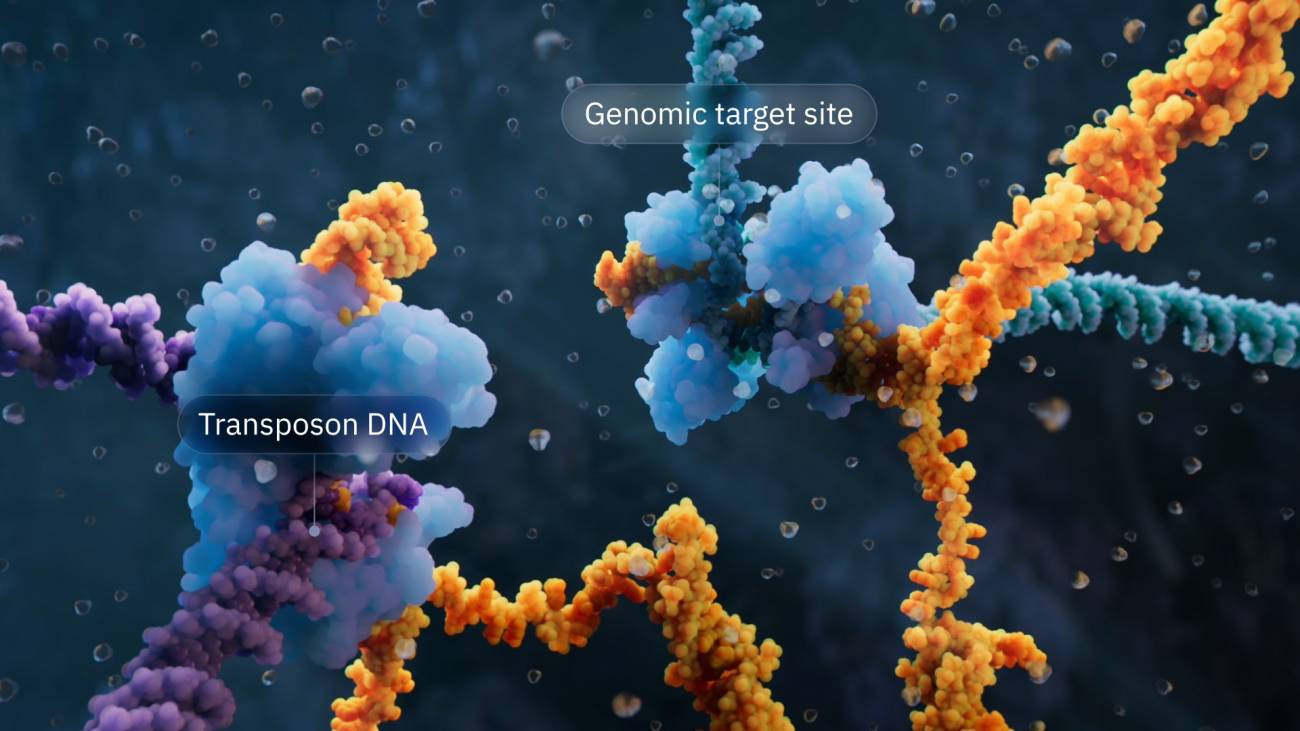
Visualización del mecanismo de la recombinasa puente que destaca el ADN del transposón y el sitio diana genómico. / Visual Science
La estructura reveló el mecanismo detallado de cómo la enzima IS110 y el ARN puente reconocen el ADN donante y el ADN diana, cortan las dos cadenas de ADN, las intercambian y religan, y después cortan e intercambian las dos cadenas de ADN restantes, completando la recombinación.
“Esta información sobre el complejo IS110-ARN puente puede utilizarse para diseñar este sistema y crear variantes más eficaces que puedan funcionar en células humanas”, puntualiza el investigador.
Si bien este nuevo descubrimiento es prometedor, es importante señalar que CRISPR ha sido optimizado durante más de una década por miles de laboratorios y empresas que invirtieron miles de millones de dólares para permitir aplicaciones terapéuticas.

Será importante investigar si este método puede utilizarse para aplicaciones de ingeniería genómica en células humanas

“Este primer conjunto de artículos presenta un tipo de ARN guía mecánicamente novedoso y la primera recombinasa de ADN guiada por ARN”, indica Hsu. “Para optimizar la edición de puentes y convertirla en una herramienta útil, tendremos que realizar estudios exhaustivos similares sobre su alcance, eficacia y posibles efectos no deseados en diferentes tipos de células y métodos de administración”.
Además, en estos trabajos no se ha demostrado que el sistema IS110 funcione en células humanas. “Será importante investigar si puede utilizarse para aplicaciones de ingeniería genómica en ellas. Además, encontramos enzimas de la familia IS110 con secuencias diversas en otras bacterias, lo que hace interesante analizar sus funciones y mecanismos”, concluye Nishimasu.