Un equipo del MIT ha automatizado una tecnología para obtener imágenes en 3D de cada mitad del cerebro humano en poco más de cuatro días. Como si de un zoom se tratase, obtiene simultáneamente la visión de un hemisferio completo y ‘desciende’ hasta las estructuras más pequeñas de las neuronas, o incluso las sinapsis, siguiendo con precisión estas conexiones.
“Mapear cerebros completos es difícil y requiere mucho tiempo, incluso con la mejor tecnología moderna”, señaló en marzo del año pasado un equipo internacional de las Universidades Johns Hopkins y Cambridge, que logró reconstruir el conectoma de este órgano en la larva de mosca tras 10 años.
Ahora, un grupo del Instituto de Tecnología de Massachusetts (MIT) lo ha conseguido en un tiempo récord y en humanos. Los investigadores han automatizado una técnica para adquirir imágenes en 3D de cada mitad del cerebro en poco más de cuatro días.
Esta nueva tecnología obtiene simultáneamente, como si de un zoom se tratase, la visión de un hemisferio completo del cerebro y va ‘descendiendo’ hasta las estructuras más pequeñas de las neuronas, o incluso las sinapsis.
El proceso para tener una fotografía completa del cerebro a escala celular requiere dividirlo en cientos o miles de delgadas rodajas de tejido, obtener imágenes de cada una de ellas al microscopio electrónico y posteriormente llevar a cabo un minucioso proceso de reconstrucción de todas esas piezas, neurona por neurona, en un cerebro completo para lograr un mapa preciso.
A ese ritmo de trabajo el conectoma del cerebro humano, fundamental para conocer cómo funciona y abordar después la infinidad de enfermedad que le aquejan, sería una tarea de titanes.
Sin embargo, el nuevo abordaje presentado en Science por Kwanghun Chung y su equipo podría facilitar en gran manera esa ardua tarea. Chung es ya conocido por ser uno de los creadores en 2013, junto con Karl Deisseroth, de la técnica Clarity, que hizo posible transparentar pequeños cerebros enteros y que hoy se utiliza rutinariamente en el laboratorio.
Desde entonces, el experto ha seguido en esa línea para mejorar la visión en 3D del cerebro con total precisión independientemente de la escala. Con la nueva publicación, ha dado un paso importante al facilitar aún más la observación del cerebro con máximo detalle, minimizando los daños que sufre el tejido cerebral durante la etapa de preparación de las muestras para que pueda volver a utilizarse posteriormente.
Llevado a cabo en colaboración con un equipo de jóvenes ingenieros, el trabajo publicado en Science pretende cambiar la forma de mirar de cerca el cerebro, salvando los escollos derivados de las técnicas actuales. Es destacable que hayan logrado recomponer los cortes del tejido cerebral para que ‘casen’ perfectamente, como si no se hubieran cortado, lo que hasta ahora requería una lenta y laboriosa integración.
Para ello, el primer paso ha sido afinar en la forma de cortar las muestras de tejido cerebral. De ello se ha encargado el ingeniero mecánico Ji Wang, que ha puesto a punto un ‘megatomo’, un dispositivo para cortar los hemisferios cerebrales humanos de manera sin que se dañen para luego volver a reconstruirlos con gran precisión para tener una visión de conjunto.

Ninguna tecnología obtiene imágenes de la anatomía completa del cerebro humano con resolución subcelular sin cortarlo primero, porque es opaco y muy grueso, aproximadamente 3000 veces el volumen del cerebro de un ratón

Como explica Chung, hasta el momento “ninguna tecnología obtiene imágenes de la anatomía completa del cerebro humano con resolución subcelular sin cortarlo primero, porque es opaco y muy grueso, aproximadamente 3000 veces el volumen del cerebro de un ratón”.
Pero con este megatomo, los cortes no pierden información anatómica en lo puntos de corte ni en ningún otro lugar, destacan los investigadores.
Otro obstáculo que salvar era aumentar la flexibilidad de las muestras sin que rompieran. Y de este aspecto se ha ocupado Juhyuk Park, un joven ingeniero de materiales que ha logrado que cada porción de cerebro transparente sea flexible y relativamente fácil de manejar, duradera y expandible.
Además, se puede etiquetar con distintos marcadores de manera rápida, uniforme y repetida, porque este marcaje selectivo puede ‘borrarse’, lo que permite hacer diferentes estudios en la misma muestra en función del fin que se persiga. Y para ello han desarrollado otra nueva tecnología incorporada en la plataforma que han denominado mELAST.
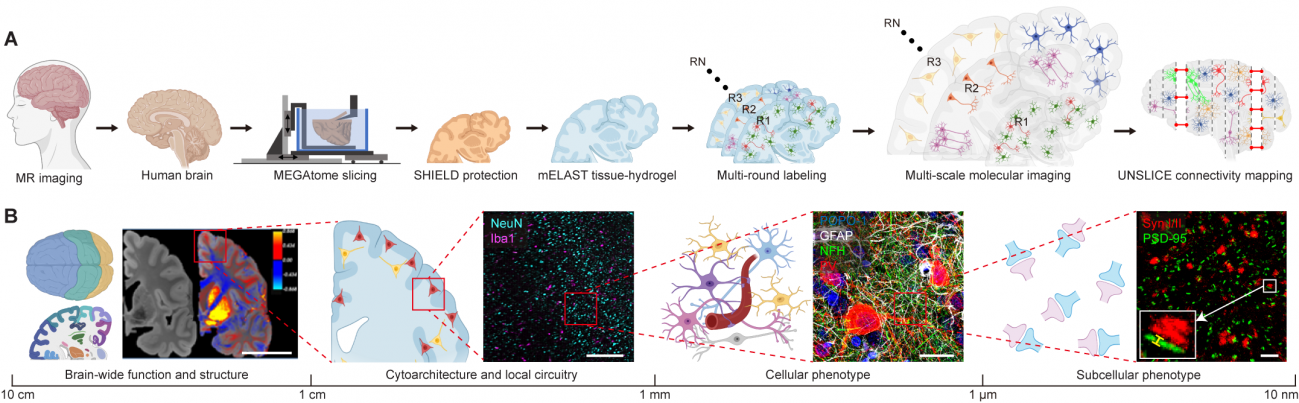
Imágenes para distinguir la estructura cerebral a gran escala (izquierda), a circuitos, a células individuales a sinapsis individuales (derecha). / Laboratorio Chung | Instituto PIcower del MIT
Por supuesto, no podía faltar un análisis computacional, que en este caso ha permitido llevar a cabo de manera automática y con gran precisión la labor de reunir las rodajas en las que se ha dividido el tejido cerebral.
La reconstrucción se lleva a cabo utilizando como guía la alineación precisa de cada vaso sanguíneo y cada axón de las neuronas, y con un software que recompone al nanómetro el cerebro como si no se hubiera cortado previamente, desarrollado por otro ingeniero, Webster Guan. Para tal fin creó un sistema computacional llamado "UNSLICE".
Con estas tres técnicas integradas en la plataforma tecnológica se puede cambiar la escala de visualización para mapear simultáneamente un hemisferio completo y al mismo tiempo acceder también a características microscópicas como información molecular, morfológica y de conectividad. Y todo ello, aseguran los investigadores, sin destruir la muestra.
En definitiva, esta nueva técnica permite un viaje inmersivo al cerebro, desde la totalidad de un hemisferio hasta el interior de las estructuras celulares más pequeñas o la visualización de las sinapsis con todo detalle.
“Esta tecnología realmente nos permite analizar el cerebro humano en múltiples escalas. Potencialmente, se puede utilizar para mapear completamente cerebros humanos”, aclara Chung.
El tiempo para preparar las muestras de cerebro es otro aspecto destacable de esta nueva plataforma, ya que reduce considerablemente. Con esta tecnología lo que antes llevaba varios meses, ahora puede realizarse en poco más de cuatro días.
Para el neurocientífico Manuel Valero, líder de grupo en el Instituto Hospital del Mar d'Investigacions Mèdiques (IMIM) y premio Jóvenes Investigadores 2023 de la Sociedad Española de Neurociencia, que no ha participado en el estudio, “el impacto de este artículo reside en la coordinación de todas estas mejoras técnicas con el objetivo de automatizar y optimizar el análisis histológico y molecular de fragmentos grandes de cerebro humano”.
Para Valero, este trabajo supone un gran esfuerzo técnico y de destreza, “que intenta mejorar el límite técnico experimental y analítico para estudiar muestras de cerebro humano con técnicas de microscopia desde el punto de vista molecular, celular y de conectividad”.
“Si bien, ninguna de estas mejoras son revolucionarias, la adopción por parte de la comunidad científica de algunos de estos recursos, por ejemplo, de los métodos de análisis desarrollados que son de fácil diseminación, puede tener un impacto a corto y medio plazo, principalmente en la optimización y automatización de este tipo estudios del cerebro”, añade.
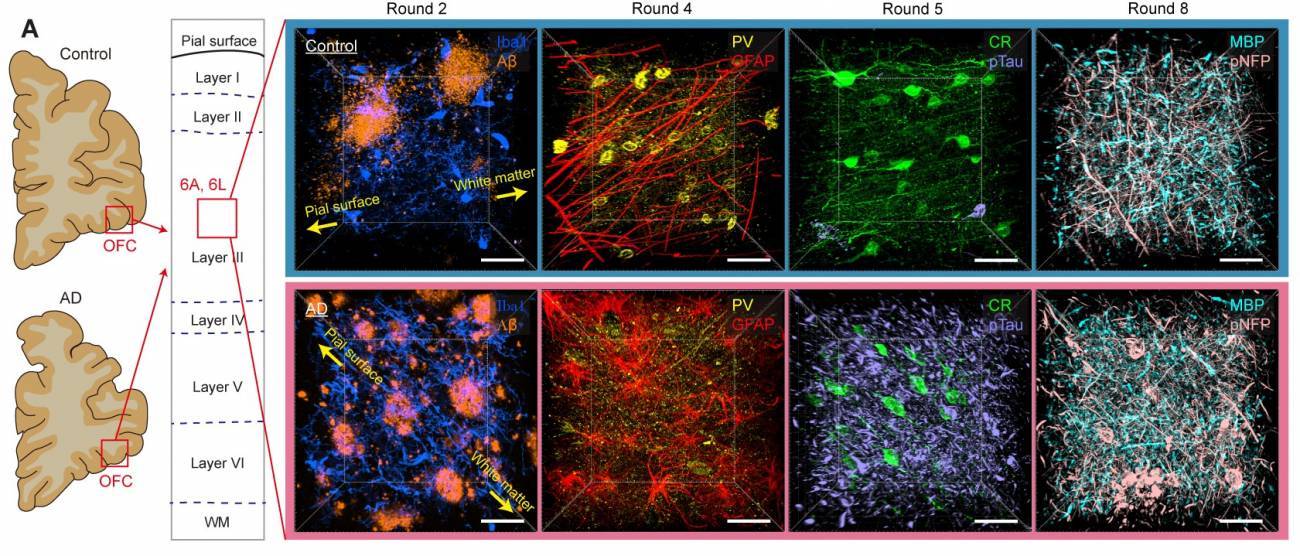
Comparación de lo que puede verse en la corteza orbitofrontal de muestras de cerebro de control y de alzhéimer: en la ronda 2 de etiquetado se aprecia mucha más beta amiloide (AB) en la muestra con patología (fila inferior). Lo mismo ocurre con la Tau fosfirilada (pTau) en la ronda 5. / Laboratorio Chung | MIT
Precisamente para demostrar las posibilidades de esta nueva técnica, los investigadores del MIT se han adentrado en un cerebro con alzhéimer y lo han comparado con otro sin esta enfermedad neurodegenerativa.
Con ello han llevado a cabo una prueba de concepto del alcance y utilidad de su nueva técnica, aunque aclaran que lo observado en un único cerebro no debe generalizarse. Pero sí abre la puerta a una nueva forma de abordaje más rápida y con gran detalle.
En este caso Chung ha colaborado con Matthew Frosch, experto en Alzheimer y director del banco de cerebros del Hospital General de Massachusetts. Los investigadores se centraron en una porción de tejido en la que observaron la mayor pérdida de neuronas en comparación con un cerebro de control sano. A partir de ahí, se dejaron llevar por su curiosidad, indican: “No diseñamos todos los experimentos de antemano", señala Chung.

Prevemos que esta plataforma tecnológica escalable mejorará nuestra comprensión de las funciones de los órganos humanos y los mecanismos de las enfermedades para estimular el desarrollo de nuevas terapias

Sabiendo que, gracias a este nuevo abordaje, podían tener acceso casi ilimitado al tejido y que les permitía incluso volver atrás y mirar algo nuevo, utilizaron muchos marcadores diferentes, para poder observar diferentes aspectos, y para caracterizar y ver las relaciones entre factores patógenos y los diferentes tipos de células.
Una de las muchas observaciones que hicieron fue que la pérdida de sinapsis se concentraba en áreas donde había una superposición directa con las placas amiloides características de la enfermedad de Alzheimer. Sin embargo, fuera de las áreas de placas, la densidad de sinapsis era tan alta en el cerebro con patología como en el cerebro sano que utilizaron como control.
Esta tecnología no se limita al cerebro, apuntan los investigadores, sino que se puede aplicar igualmente a muchos otros tejidos del cuerpo. “Prevemos que esta plataforma tecnológica escalable mejorará nuestra comprensión de las funciones de los órganos humanos y los mecanismos de las enfermedades para estimular el desarrollo de nuevas terapias”, concluye Chung.
Referencia:
Park, J. et al. Integrated platform for multiscale molecular imaging and phenotyping of the human brain. Science (2024).